打通体内基因编辑治疗最后一公里,蔡宇伽团队开发我国首个原创基因治疗载体:类病毒体
文章正文
发布时间:2024-07-24 22:07


编辑 | 王聪排版 | 水成文
自最早的基因编辑工具问世至今,基因编辑技术已经有近30年的历史了。特别是2012年以来,随着
CRISPR
的横空出世,基因编辑技术日渐趋于成熟。
然而遗憾的是,相对于基因编辑工具本身的快速进化,其递送技术的发展极其缓慢和困难。而递送之于基因编辑治疗的重要性如同火箭之于登月。由于递送技术的滞后发展,体内基因编辑治疗的临床应用困难重重,整个领域都在期待递送技术的突破。
2020年初,诺奖得主 Jennifer Doudna 在 Nature 杂志发表综述,系统论述了基因编辑治疗的前景和挑战,在展望CRISPR美好应用前景的同时,这位CRISPR技术的奠基人发出了‘
递送可能仍然是基因编辑体细胞治疗的最大瓶颈
’
(Delivery remains perhaps the biggest bottleneck to somatic-cell genome editing)
的感叹。

近几年来,基因编辑工具本身的发展令人眼花缭乱,各种Cas9变体、碱基编辑工具及其变体、Prime Editor等,层出不穷。
但是,这些工具的临床应用必须回归到递送,而迄今为止可选的递送工具还是有几十年历史的‘老三件’:
AAV
、
慢病毒
以及
纳米材料
。
尽管这些递送载体广泛用于基础研究,但它们却不太适合直接用于临床。基因编辑的临床应用有着安全性和有效性的双重标准。一方面,病毒载体由于长时间的表达基因编辑酶,会带来安全性上的不确定性;另一方面,纳米材料则面临效率上的挑战。
2020年上半年,张锋作为创始人的著名基因编辑治疗科技型企业Editas Medicine实施了首例人体基因编辑治疗的临床研究()。但由于该研究使用AAV作为载体,CRISPR将长期与患者共存,具有一定的风险。
理想的基因编辑递送工具需要兼具瞬时和高效的特点,以确保治疗的安全性和有效性。近日,上海交通大学系统生物医学研究院的
蔡宇伽
团队在 Nature 子刊 Nature Biomedical Engineering 杂志上发表了题为:
Lentiviral delivery of co-packaged Cas9 mRNA and a Vegfa-targeting guide RNA prevents wet age-related macular degeneration in mice
的研究论文。
该研究发明了一种介于病毒载体与非病毒载体之间的
类病毒体
(virus-like particle,
VLP
)
递送技术
。
VLP可以递送CRISPR/Cas9 mRNA,实现安全和高效的体内基因编辑
。值得一提的是,该技术是
我国首个完全自主开发的原创型基因治疗载体
,体现了我国在基因治疗领域的科技进步。

蔡宇伽
博士表示:实现基因编辑酶在体内的瞬时递送是基因治疗科学家的梦想。有了这样的载体,我们可以最大限度地提高基因编辑治疗的安全性,也意味着基因编辑体内治疗离临床应用无限接近。然而,实现这个梦想并不容易,也几乎没有人相信可以成功。我从博士生时代开始尝试, 到现在成为博士生的导师,
经过10年时间的不断地探索与积累,直到最近才取得了核心突破
。慢病毒载体
可以高效感染几乎所有的细胞,而非病毒成分mRNA具有瞬时性的特点。蔡宇伽团队利用mRNA茎环结构与噬菌体衣壳蛋白特异识别的原理,通过病毒工程技术,将两者的优点完美的结合起来,创造了新型递送技术
VLP-mRNA
。
通过VLP-mRNA递送Cas9 mRNA,Cas9的存在时间只有72小时。研究发现,与长时间表达Cas9的病毒系统相比,
VLP-mRNA可以显著降低、甚至完全避免脱靶效应
。另外,VLP-mRNA可以递送整个CRISPR元件
(Cas9与gRNA)
,
克服了AAV载体运载能力小的限制,甚至可以递送更大的碱基编辑工具
。研究团队还将VLP-mRNA技术用于眼科疾病的治疗。
老年性黄斑变性
(AMD)
是一种退行性眼底疾病。患者表现为中心视力下降、视物变形、周边部或中心视野出现暗点,对老年人的生活 质量造成极大的影响。
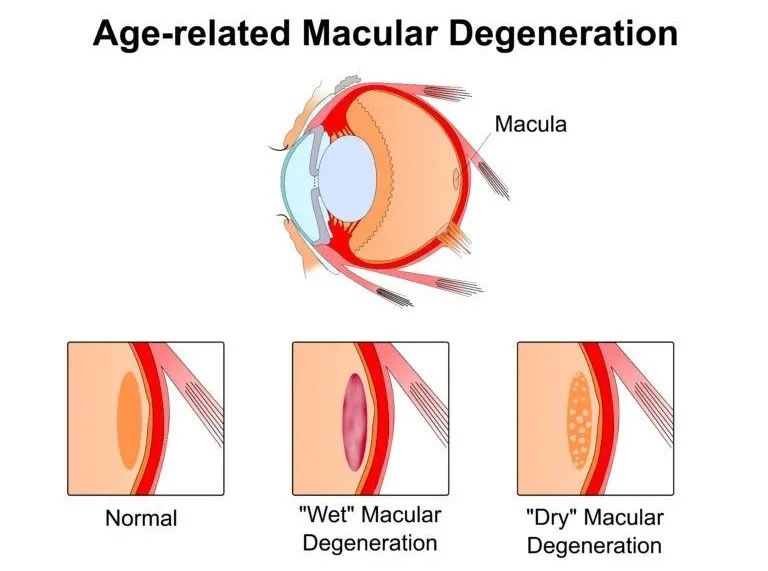
据统计,西方发达国家中 70 岁 以上的老年人罹患 AMD 者超过 40%。随着我国老年人口日渐增多,黄斑变性的发病率也越来越高。另外,糖尿病患者也可能罹糖尿病相关黄斑变性,总体发病率在10%左右。目前,黄斑变性的治疗方法是VEGF单克隆抗体。然而,抗体需要反复给药;另外,抗体外溢可导致严重的副反应。
研究团队利用激光诱导的小鼠黄斑变性模型,通过视网膜下腔注射的方式,发现CRISPR特异性的分布在视网膜色素上皮细胞
(RPE)
,而RPE 细胞是眼内VEGF的主要来源。
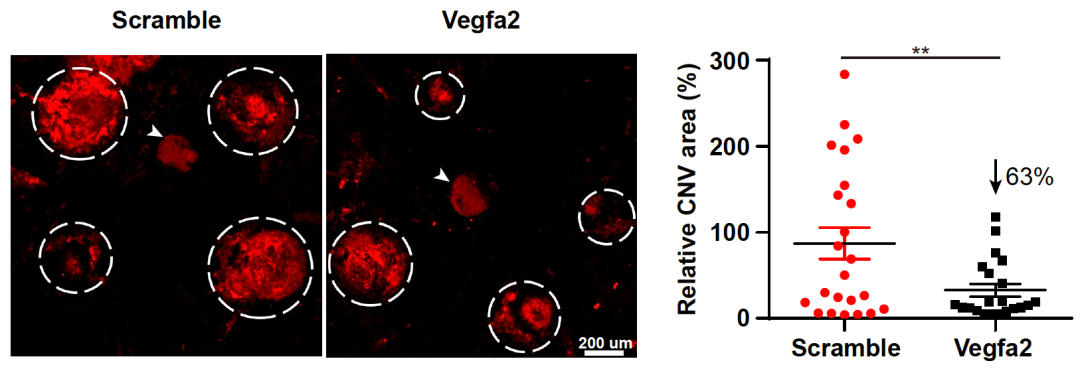
VLP递送CRISPR实现了高达44%的Vegfa基因敲除,降低了63%的新生血管面积。二代测序表明VLP-mRNA未诱导出脱靶效应。
对于此前报道的AAV递送CRISPR引起的大片段缺失,研究团队通过三代测序,仅能发现勉强高于背景的信号。值得一提的是,VLP mRNA无论在体外还是在眼内,均未引起免疫反应。这些实验结果有力支持了CRISPR在黄斑变性基因治疗上的临床应用潜力。
总的来说,
VLP-mRNA是一种通用型的、瞬时性的CRISPR递送工具,兼具高效和安全的优点
。该技术无疑将帮助CRISPR体内基因编辑治疗时代的真正来临,为无药可治或有药难治的遗传性、获得性以及感染性疾病的患者带来新的希望。

蔡宇伽研究员
据悉,上海交通大学博士生凌思凯是本文的第一作者,上海交通大学附属第一人民医院眼科临床医学中心的杨仕琪博士、孙晓东教授也为本研究的完成做出了重要贡献。复旦大学附属眼耳鼻喉科医院、瑞金医院、中科院、丹麦奥胡斯大学的科学家参与了本研究。 论文链接
:https://www.nature.com/articles/s41551-020-00656-y
